Basado en el reporte presentado por la Oficina de Calidad Farmacéutica (OPQ) de la FDA.
El estado de la calidad farmacéutica es la condición construida a partir de varios indicadores de la capacidad de los productores farmacéuticos para ofrecer productos de calidad a pacientes y consumidores.
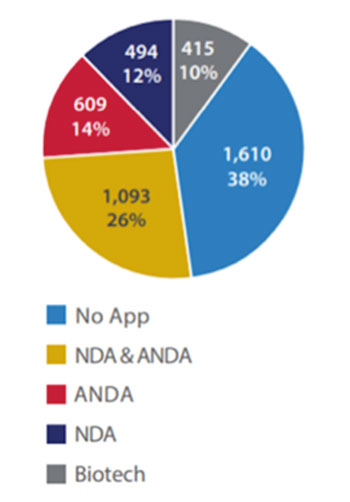 Durante 2021 hubo una disminución de sitios de manufactura en el catálogo, de 4,273 en 2019 a 4,221 en 2020. Es importante destacar que este total no incluye a los fabricantes de gases medicinales ni de desinfectantes recientemente registrados. De este total, 1,160 (38%) de los sitios de fabricación se encuentran en el sector “sin aplicación”, lo que indica que todos los productos fabricados en ese sitio son los que se comercializan sin una aplicación aprobada, incluyendo los productos de libre venta (OTC), productos no aprobados y productos homeopáticos. El resto de los sitios, 2,611 (62%) están involucrados en la fabricación de, al menos, un producto de las distintas aplicaciones.
Durante 2021 hubo una disminución de sitios de manufactura en el catálogo, de 4,273 en 2019 a 4,221 en 2020. Es importante destacar que este total no incluye a los fabricantes de gases medicinales ni de desinfectantes recientemente registrados. De este total, 1,160 (38%) de los sitios de fabricación se encuentran en el sector “sin aplicación”, lo que indica que todos los productos fabricados en ese sitio son los que se comercializan sin una aplicación aprobada, incluyendo los productos de libre venta (OTC), productos no aprobados y productos homeopáticos. El resto de los sitios, 2,611 (62%) están involucrados en la fabricación de, al menos, un producto de las distintas aplicaciones.
Como en otros años, en todo 2020 hubo más sitios involucrados en la fabricación de ambos tipos de productos, innovadores y genéricos (1,093), que sitios involucrados en la fabricación ya sea de innovadores (494) o genéricos (609). Los cinco países principales de acuerdo al número de sitios de fabricación durante 2020 fueron Estados Unidos, India, China, Alemania y Canadá, y todos tuvieron una disminución en la cantidad de sitios, pero permanecen siendo los cinco principales.
La Food & Drug Administration (FDA) trabajó mucho para proteger a Estados Unidos durante la emergencia de salud pública por el Covid-19 asegurando que hubiera tratamientos disponibles para pacientes enfermos del nuevo coronavirus tan pronto como fuera posible, monitoreando el suministro de los medicamentos y tomando acción para reducir o prevenir el desabasto de medicamentos.
Asimismo, la agencia publicó más de 60 guías involucradas con el estado de emergencia en un esfuerzo de proporcionar información a la industria farmacéutica, incluyendo información sobre el desarrollo de medicamentos y productos biológicos durante la pandemia y asesoría sobre cómo informar a la agencia de cualquier interrupción en las operaciones que pudieran resultar en interrupciones en la cadena de suministro.
Los esfuerzos de la FDA también se centraron en aprobar medicamentos para el tratamiento de pacientes con Covid-19, cubrir la mayor demanda de desinfectante para manos a base de alcohol y asegurar la disponibilidad de tapas de contenedores de medicamentos y vacunas en vista de un incremento en la demanda de productos parenterales.
Como parte de la respuesta a la pandemia, la FDA emitió una guía que detalla una normativa temporal sobre la preparación de desinfectantes para manos base alcohol durante el Covid-19. Esta guía describe las condiciones para que miles de destilerías y otros fabricantes industriales registren y produzcan desinfectantes para manos a base de alcohol para satisfacer la demanda de estos productos en Estados Unidos. Hubo un incremento importante en los sitios registrados con 6,743 nuevos registros en 2020 vs. 740 en 2019. La mayoría son de fabricantes de desinfectantes para manos, de los cuales 3,688 se dieron de baja. Actualmente, existen 1,623 nuevos registros en el mundo considerados como fabricantes en el catálogo del CDER en lo que va de 2021, 94% son fabricantes de desinfectantes para manos.
Con la introducción de nuevos registros llegaron muchos fabricantes que no tenían experiencia previa en la fabricación de desinfectantes para manos. Para hacerle frente a esto, la FDA probó los desinfectantes de manos importados y emitió una asignación de muestreo y prueba de vigilancia nacional diseñada estadísticamente que abarca alrededor de 300 empresas y se basa en diversos factores de riesgo.
En conjunto con el Sistema Nacional de Datos de Envenenamientos (NPDS, por sus siglas en inglés), la agencia revisó el incremento en los reportes por ingestión de desinfectantes de manos, en los que hubo algunos casos fatales o condujeron a una discapacidad permanente debido a la presencia de metanol, un contaminante encontrado en algunos desinfectantes que no cumplen con los estándares. Los informes de quejas de productos alcanzaron su máximo en julio de 2021 con 120 reclamos.
Después hubo una disminución en los reclamos que siguieron de algunas devoluciones voluntarias coordinadas por la agencia. Posteriormente, muchos de los productos desinfectantes de manos se agregaron a la lista de “Productos que no se deben usar” de acuerdo a las pruebas de la FDA.
En respuesta a la pandemia mundial, el departamento del estado emitió restricciones de viaje a China lo que ocasionó que la FDA pospusiera todas las inspecciones no críticas. Sin embargo, realizó 562 inspecciones de aseguramiento de calidad de medicamentos en todo 2020. Aunque la mayoría fueron antes de la emergencia de salud pública, la FDA continuó realizando inspecciones durante la pandemia.
Durante el año se emitieron menos cartas de advertencia que en los dos años anteriores.
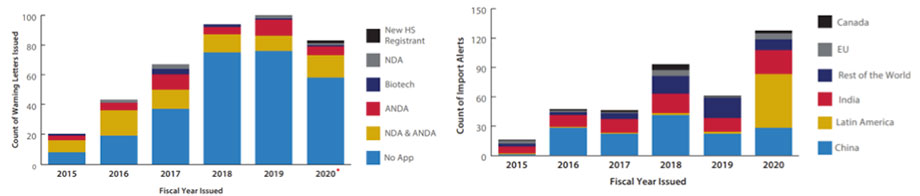
La FDA emite alertas de importación para prevenir que entren determinados productos al país. Las alertas se duplicaron durante e2020 siendo América Latina la que tuvo más alertas por los nuevos registros de desinfectantes de México que no cumplieron estándares de calidad.
Se asigna un puntaje de inspección de sitio (SIS, por sus siglas en inglés) que va del 1 al 10 como cumplimiento de Buenas Prácticas de Fabricación. Esto implica diseño apropiado, control de los procesos de fabricación e instalaciones y representa el estándar mínimo con el que los sitios deben cumplir. Hubo una disminución de la media del SIS de 0.10 en el total de sitios. El sector que tiene la media más baja es el de homeopáticos.
Se desarrolló un modelo de regresión automático XGBoost20 para predecir el SIS utilizando datos de inspección de 10 años. Se obtuvieron combinaciones de características predictivas de aumento o disminución del factor de riesgo asociado a un SIS bajo o alto.
Los problemas de calidad en un sitio al que se hace referencia en varias aplicaciones pueden traer un riesgo sustancial ven la cadena de suministro. Las solicitudes de medicamentos hacen referencia a operaciones específicas de fabricación que se realizan en los sitios de fabricación (como, por ejemplo, formulación final, fabricación del principio activo, pruebas, etiquetado, embalaje) para hacer el producto terminado. Los sitios de Estados Unidos son los que más se mencionan en ANDAs (37,411 veces) y en NDAs.
Los problemas de calidad de producto se midieron por medio de informes de defectos de calidad del producto (PQD, por sus siglas en inglés) comprendiendo 11,932 Reportes de Efectos Adversos (MW), 4,308 Reportes de Alerta de Campo (FARs), 253 Reclamos de clientes, 263 Reportes de Desviación de Producto Biológico (BPDRs) y 2,623 muestras probadas en un periodo de 5 años desde 2016.
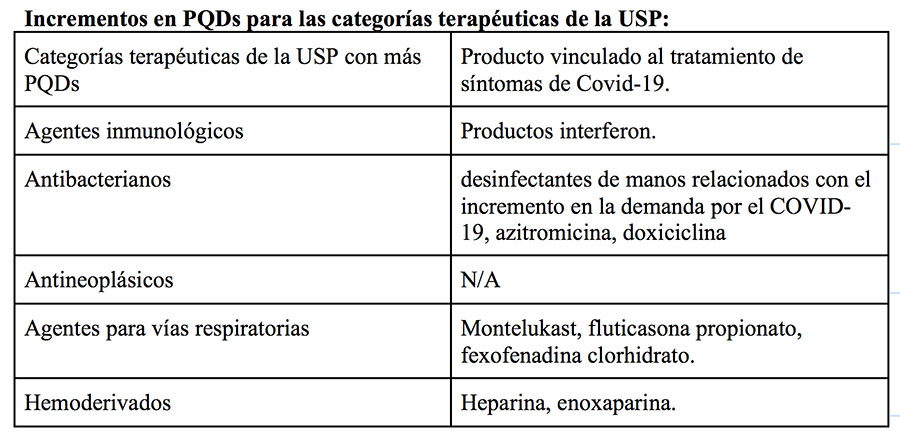
En todo 2020, el número de Defectos en la Calidad del Producto (PQDs, por sus siglas en inglés) incrementó para cinco categorías de la USP. La mayoría de esos incrementos se debió, en parte, al amplio uso de medicamentos para tratar pacientes con Covid-19. En 2020, los productos inmunológicos fueron los de mayor número de PQDs (24%).
En 2020 incrementaron los retiros de producto por segundo año consecutivo. Estos fueron por productos gastrointestinales y antibacterianos relacionados a impurezas de nitrosamina encontrados encima de los niveles aceptables en los bloqueadores H2 como la ranitidina y por contaminación de desinfectantes de manos. El sector de menos retiros fue el de los biotecnológicos y nuevos productos. El promedio SIS de los sitios que reportan al menos un retiro se mantiene por debajo de la media de SIS, resaltando la relación entre retiros y cumplimiento de las buenas prácticas de fabricación. Cada retiro importante durante los últimos cinco años fiscales estaba asociado a impurezas / contaminación microbiana o química; un área de enfoque para que mejore la calidad de la industria
Esta función de vigilancia ayuda a asegurar la calidad de los medicamentos disponibles para el público. Durante 2020, la demanda por la emergencia de salud pública enfatizó la importancia de esta misión. La FDA respondió mediante la introducción de nuevas herramientas de vigilancia y la adaptación de las existentes para cuidar la cadena de suministro mientras las inspecciones no críticas continúen pospuestas debido a las restricciones de viajes.
El número de Reportes de Inspección Mutua (MRA, por sus siglas en inglés) ha aumentado de manera notable permitiendo que los recursos de inspección sean reasignados a otras actividades de alto riesgo.
La FDA publicó recientemente una guía para Evaluaciones Remotas Interactivas para mejorar la vigilancia mientras se reducen los riesgos de exposición durante la pandemia. Estas herramientas han permitido la aprobación de varios productos, sin inspecciones y han evitado la entrada de productos de baja calidad al mercado estadounidense.
El Centro de Evaluación e Investigación de Fármacos se mantuvo a la vanguardia. Durante el año pasado, proporcionó información de la cadena de suministro, atendiendo las preocupaciones emergentes sobre la calidad de los productos e interactuando con las partes involucradas en el mundo. Dentro de las actividades realizadas estuvieron:
- Autorización de un estudio revisado por pares sobre la comparación de medicamentos difíciles de fabricar producir en distintas partes del mundo y comercializados en Estados Unidos.
- Patrocinio de un taller sobre la comprensión de cómo el público percibe y valora la calidad farmacéutica organizado por la Universidad de Duke.
- Seminario web de Calidad Farmacéutica a nivel mundial (90% de los asistentes fueron de la India y China).
A través de labores proactivas busca mejorar el futuro de la calidad farmacéutica y minimizar los problemas de escasez de medicamentos debido a la calidad.
- Nuevo proyecto de protocolo de inspección (NIPP, por sus siglas en inglés), utilizando protocolos electrónicos estandarizados para recopilar información de manera estructurada. Entre más información se reúna se pueden identificar oportunidades de mejora.
- Madurez de la Gestión de la Calidad
A pesar de las circunstancias, los pacientes y consumidores de Estados Unidos merecen confiar en su próxima dosis de medicamento. La FDA continuará comprometida con las partes involucradas, respondiendo a los cambios en las circunstancias con base a la ciencia y riesgo, desarrollando programas innovadores y compartiendo información de la calidad farmacéutica, todo en una labor que asegure el suministro de medicamentos de calidad, seguros y efectivos para el público.
Por: QFB Nadia Martínez González












