Índice del artículo
Comenzaremos con la Validación de Proceso (fig.1), haciendo un comparativo actual y tradicional y los requerimientos normativos (fig. 2)
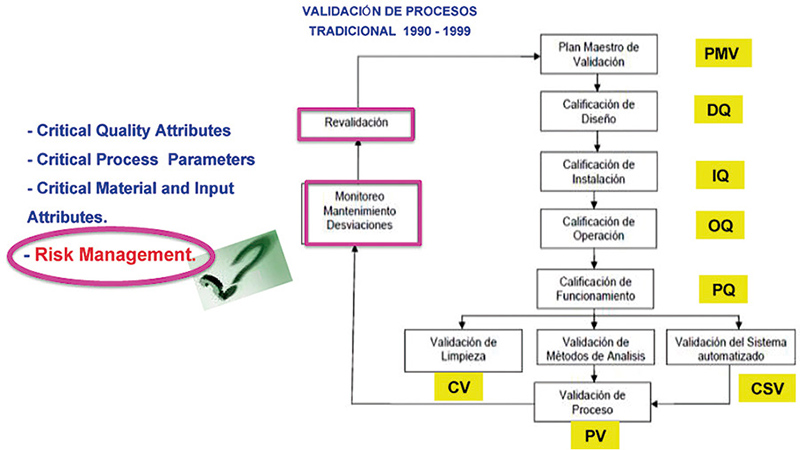
Figura 1
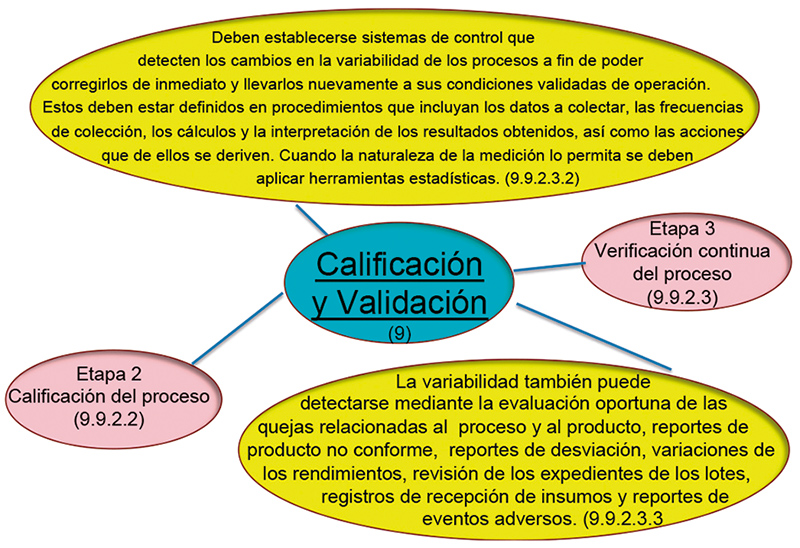
Figura 2
Tenemos complementos interesantes ahora, los cuales son: gestión de riesgos, identificación de CQA, CPP y CMAIA, uso de estadística para generar sistemas de control que detecten los cambios en la variabilidad de los procesos (Six Sigma) y la forma de afectación por la variabilidad debida a los reportes colectados por el sistema de calidad (9.9.2.3.3), siendo el reto que lo enfoquemos a la oportunidad de generar valor al negocio a través del cumplimiento regulatorio. (fig.3).

Figura 3
Por lo que, con estas armonizaciones internacionales FDA – EMA – OMS – NOM-059-SSA1-2015, serie ISO, principalmente, necesitamos cambiar la forma de pensamiento, romper paradigmas, pensar fuera de la caja, si todos los caminos nos llevan a Roma, esto indica que todo nos lleva al concepto Lean Validation, el mantenimiento del estado validado en los tres lotes de validación en todo el ciclo de vida del producto de los lotes comerciales, y correlacionarlo a la estrategia de control a desarrollar e implementar en el proceso de validación. (fig. 4 y 5).

Figura 4
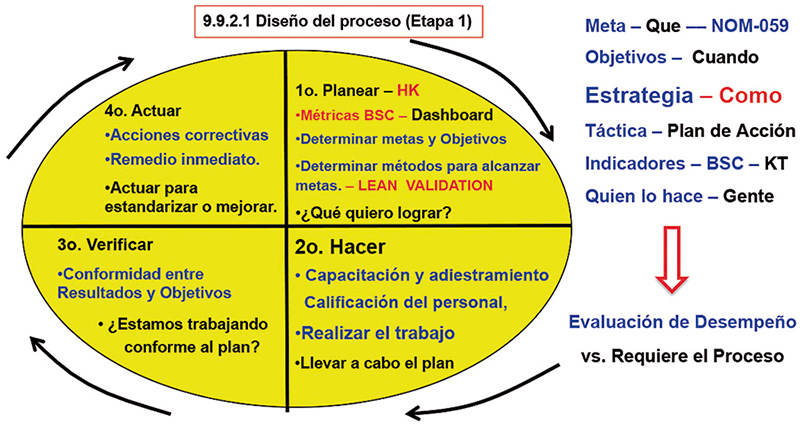
Figura 5
La ICH Q 10, Sección 3.2.1, PP & PQM (Desempeño del proceso & monitoreo de la calidad del producto) indica que debemos identificar fuentes de variación que afecten el desempeño del proceso y la calidad del producto, para una potencial mejora continua en las actividades con el objetivo de reducir o controlar la variación, haciendo referencia tanto a la variación por causas comunes, como a la variación por causas especiales. Es necesario saber ambas para reducirlas o corregirlas (fig. 6 eje y límites y eje x días), niveles Lean Six Sigma, por lo que tenemos que generar todo un plan de acción para estar en línea con el estado de control conforme ICH Q10. (fig. 7).
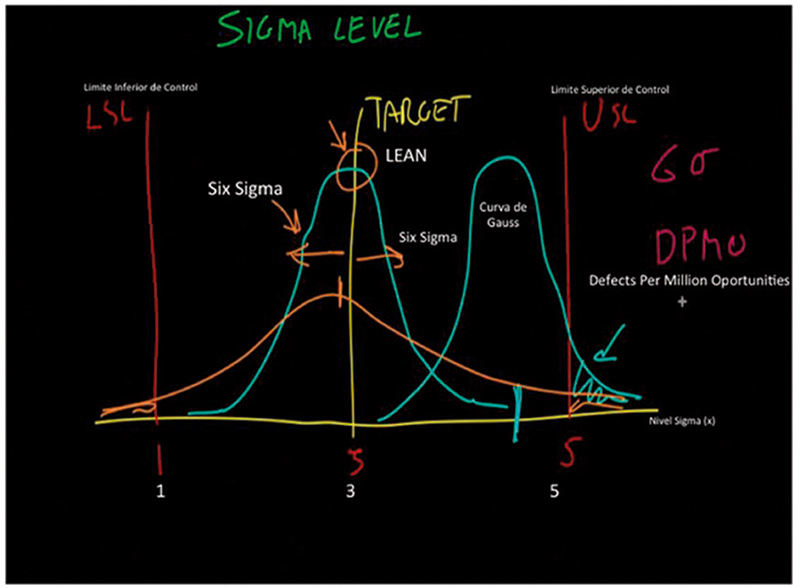
Figura 6

Figura 7
Analizando detenidamente esta comparativa entre FDA y Unión Europea (fig.6), es interesante ver el proceso de mejora, mientras la 1ra se enfoca en implementar, probar y comprobar durante el proceso de manufactura, mediante la colección y evaluación de datos, partiendo de la etapa 1 (diseño), que un proceso es capaz de entregar cumpliendo con la calidad requerida, por otro lado tenemos que, desde la perspectiva de la Unión Europea, anexo 15, se enfoca en documentar que el desempeño del proceso de manufactura ha sido operado dentro de los parámetros establecidos, desempeñándose de una manera efectiva, monitoreando los atributos críticos de calidad del producto, así como realizando la medición y el análisis estadístico de los parámetros críticos de procesos y los atributos críticos de calidad identificados en la estrategia de control (estado 2).
Por esta razón es que al apoyarnos en la información que nos generan todos los sistemas de calidad, que incluyen a todos los servicios proporcionados a la planta a los procesos productivos y a la cadena de valor externa, tenemos que en la implementación de las etapas 1, 2 y 3 tendremos la oportunidad de detectar potenciales efectos de falla, implementar sistemas de monitoreo continuo (estado 2), y mejorar en la red de valor de la organización al aplicar las lecciones aprendidas en las actividades de evaluación de tendencias, mantenimientos predictivos (TPM), eventos Kaizen en la fuente en la cual se genera la calidad del producto (fig. 8), integrando a los operadores y formándolos en conocimientos Yellow Belts, que apoyen entregando la información requerida a los analistas (Green Belts) de la información, aplicando la estadística y analizando los gráficos de tendencias en beneficio de la mejora continua de los procesos (Black Belts), reflejándose los resultados en un incremento en el ROI (Retorno de la inversión), representados visualmente en la fig. 9, 10 y 11.
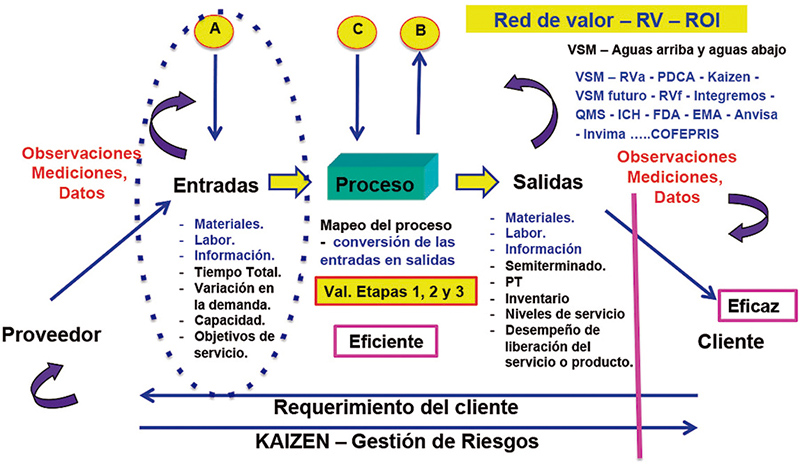
Figura 9
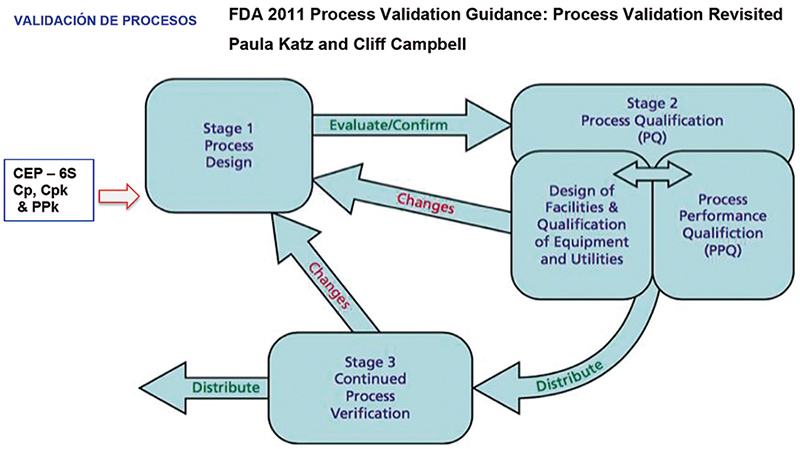
Figura 10
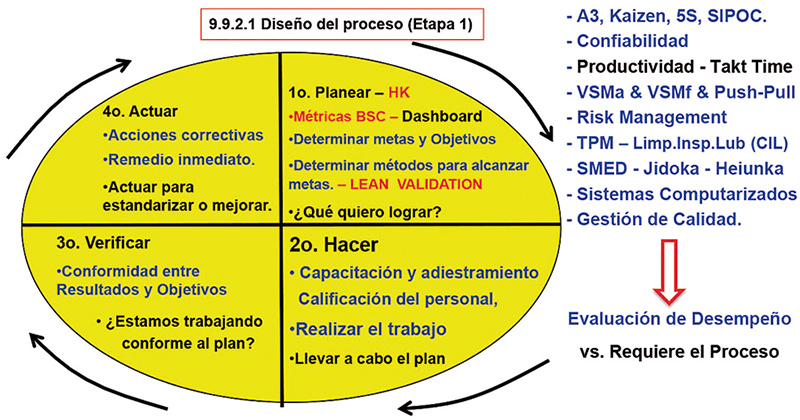
Figura 11
Generando valor al negocio, fortaleciendo los procesos durante la implementación de la etapa 2 en la validación de los procesos y en cumplimiento del anexo 15 (2001), en la que se evalúa el desempeño del proceso, reducción en la variabilidad natural del procesos lote a lote, a través del monitoreo de la calidad del producto (fig.12), haciendo mayor énfasis en las principales fuentes de variabilidad previas a las entradas del procesos:
- Materiales (APIs, excipientes, procesos).
- Equipos
- Procedimientos y registros maestros.
- Medio ambiente.
- Operadores/gente
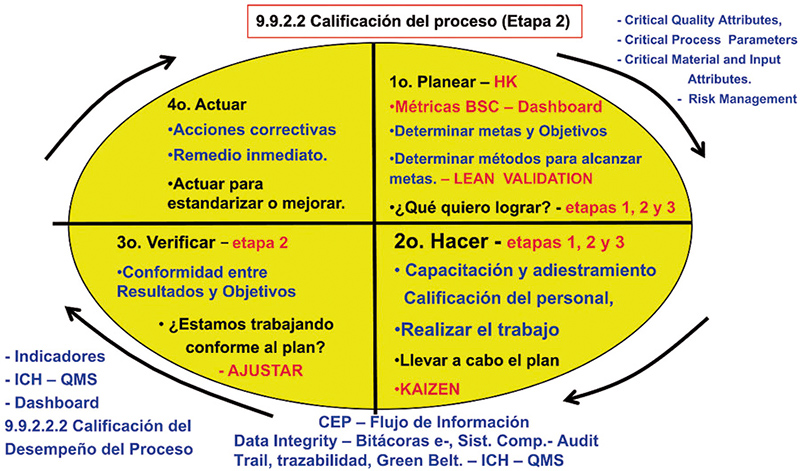
Figura 12
Al tener controlada la variabilidad del proceso con base en la estrategia de control, mantendremos el flujo del proceso, sin paros y sin desperdicios, con una filosofía de trabajo Lean para mejorar, reduciendo el tiempo ciclo del proceso y en consecuencia lead time, a través de la eliminación de desperdicio (muda), al hacer flexible y ágil (Velocity), la operación, al eficientar la cadena de valor con un enfoque en el incremento del OEE (Overall Equipment Effectiveness por sus siglas en inglés) o efectividad total del equipo en la que mide la efectividad del equipo, SMED (Single Minute Exchange Die por sus siglas en inglés), o en el que se miden los cambios rápidos de formato y TPM (Total Productive Maintenance por sus siglas en inglés) o Mantenimiento Productivo Total, cuyo principal enfoque es el mantenimiento autónomo, que integrándolas en la etapa 3 se mejoran los procesos, ya que se trabaja con actividades de valor agregado al negocio (fig. 13), bajo un proceso de innovación y mejora continua, conocida como etapa 3. (fig. 14).
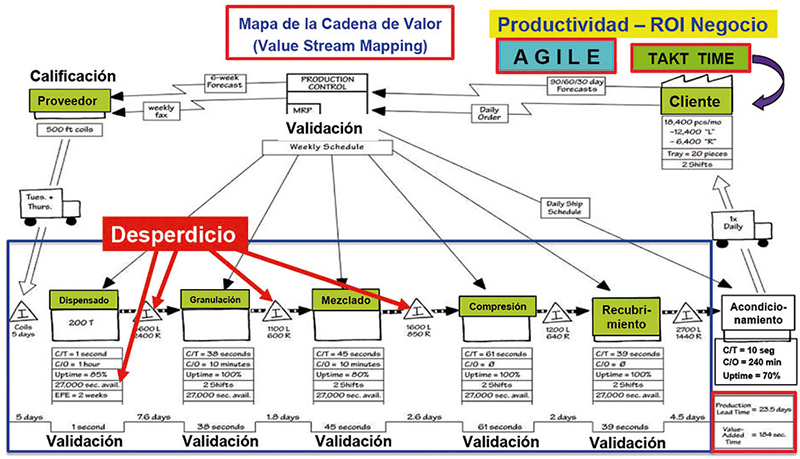
Figura 13
Transición de la etapa 2 a la etapa 3
Entendimiento total del proceso y robustecimiento al sistema de indicadores de medición de los parámetros críticos de procesos y los atributos críticos de calidad hasta el nivel establecido durante el proceso de calificación, teniendo suficientes datos disponibles para estimar la variabilidad significativa natural del proceso con base en sistemas de prevención como center lines, de alerta en la producción de lotes comerciales, de la incertidumbre a la certidumbre en la variabilidad del proceso, el cual puede ser ajustado en los límites de alerta con base en los resultados del análisis estadístico y de los criterios de aceptación, por lo que las tendencias de variabilidad del proceso deberán ser evaluadas periódicamente como una rutina de trabajo y, de esta forma, mantener el estado validado. (fig. 14).
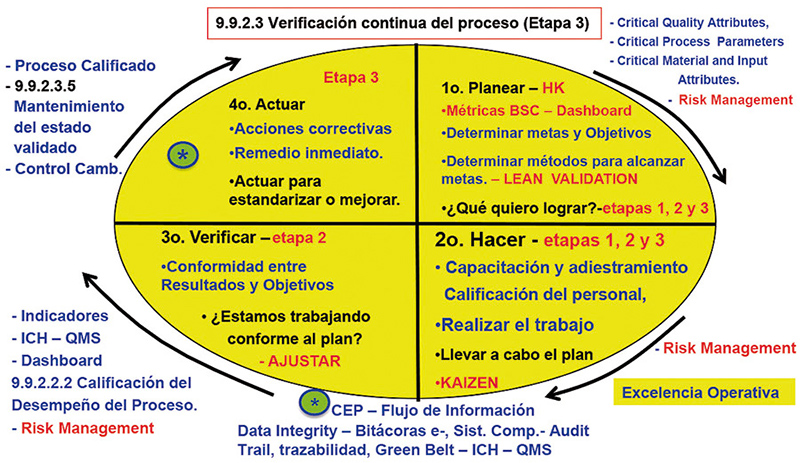
Figura 14
Una vez cubiertas en piso y en todos los procesos las 3 etapas de la validación de procesos, estaremos vigilando su continuidad y mejora como un ciclo, conocido como en todo el ciclo de vida del producto en la cadena de valor de la organización, bajo el amparo y cumplimiento de las ICH Q8, Q9, Q10, Q11 y Q12 próxima a publicarse. (fig.15).
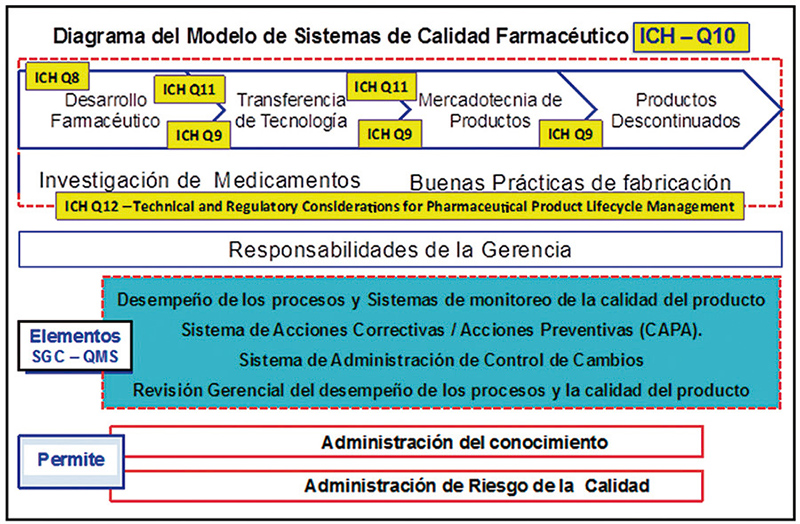
Figura 15
Tema del cual comentaremos en próximas publicaciones.
Saludos cordiales:
José Luis Ruiz Granados