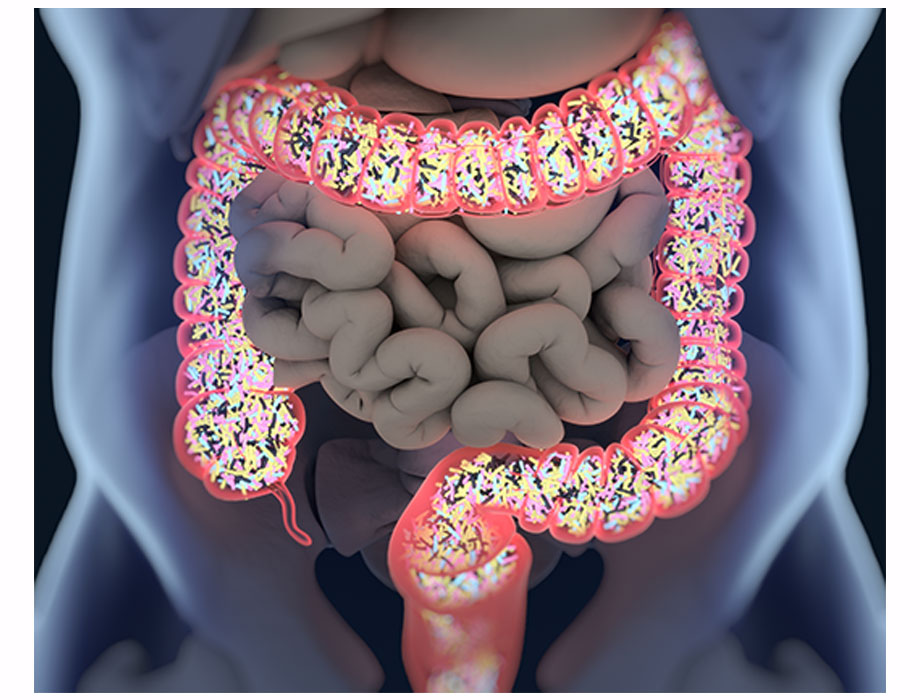
Comunicado. AbbVie y FutureGen Biopharmaceutical anunciaron un acuerdo de licencia para desarrollar FG-M701, un anticuerpo TL1A de próxima generación para el tratamiento de la enfermedad inflamatoria intestinal (EII) actualmente en desarrollo preclínico.
FG-M701 es un anticuerpo monoclonal totalmente humano dirigido a TL1A, un objetivo clínicamente validado en la EII. FG-M701 está diseñado de forma única con características funcionales potencialmente mejores en su clase en comparación con los anticuerpos TL1A de primera generación con el objetivo de impulsar una mayor eficacia y una dosificación menos frecuente como terapia para la EII.
“La prevalencia de la EII sigue aumentando y muchas personas que viven con colitis ulcerosa y enfermedad de Crohn no responden a las terapias actuales. La misión de AbbVie de elevar el nivel de atención incluye la búsqueda de terapias transformadoras que ayuden a más pacientes que viven con enfermedades autoinmunes a lograr la remisión. Esperamos nuestra colaboración con FutureGen para avanzar en el desarrollo de FG-M701 para el tratamiento de la EII”, afirmó Jonathon Sedgwick, vicepresidente senior y director global de investigación de descubrimientos de AbbVie.
Por su parte, Zhaoyu Jin, fundador y director ejecutivo de FutureGen Biopharmaceutical, dijo: “Estamos muy contentos de asociarnos con AbbVie, líder mundial en el desarrollo y comercialización de terapias autoinmunes e inflamatorias innovadoras. Creemos que AbbVie es un gran socio, con la capacidad de aplicar su experiencia y escala global para hacer realidad el potencial terapéutico de FG-M701 y hacer avanzar rápidamente esta terapia para pacientes que padecen EII. La colaboración con AbbVie también destaca la capacidad de FutureGen para generar Potenciales candidatos a productos mejores en su clase con nuestra plataforma tecnológica patentada Plataforma de Evolución Dirigida basada en Estructuras (STEP, por sus siglas en inglés)”.
Con base en los términos del acuerdo, AbbVie recibirá una licencia global exclusiva para desarrollar, fabricar y comercializar FG-M701. FutureGen recibirá 150 mdd en pagos por adelantado y por hitos a corto plazo y será elegible para recibir hasta 1,560 mdd adicionales en desarrollo clínico, hitos regulatorios y comerciales, así como regalías escalonadas de hasta dos dígitos sobre las ventas netas.
Hoy también publicamos las siguientes notas y más...
Especialistas presentan señales de alerta para identificar la enfermedad de Batten
OMS recomienda vacuna actualizada contra nueva cepa de Covid JN