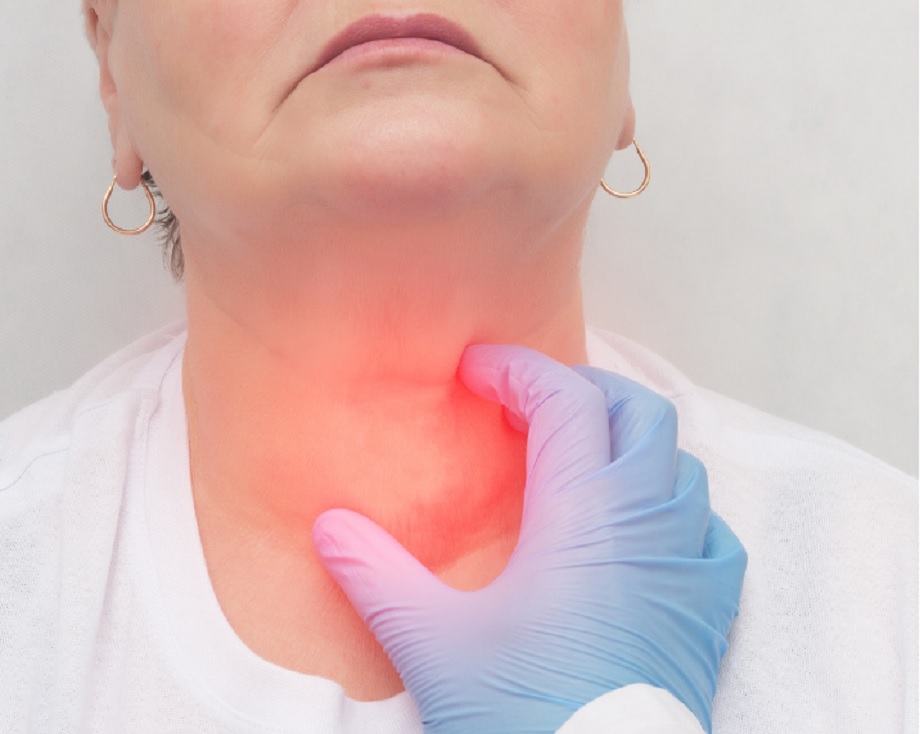
Comunicado. Existe un conjunto de manifestaciones que puede comenzar justo frente al espejo, en lugares como la lengua, las encías, la garganta o la laringe, se le conoce como Cáncer de Cabeza y Cuello (CCyC), y aunque suene extraño, hoy más que nunca está presente en personas jóvenes, especialmente por dos factores que antes pasaban desapercibidos: la salud sexual y la salud bucal.
Se trata de un conjunto de neoplasias que se originan en la vía aerodigestiva, por ejemplo: en la cavidad oral, la cavidad nasosinusal, la faringe, la laringe y las glándulas salivales. De todos ellos, las tumoraciones con más casos se presentan mayoritariamente en la cavidad oral, siendo las lesiones en la lengua las más comunes del cáncer de cabeza y cuello.
Este tipo de cáncer ocupa el séptimo lugar entre los más comunes a nivel mundial. En México, entre el 60 y 70% de los casos se detectan en etapas avanzadas, lo que reduce significativamente las posibilidades de supervivencia a cinco años, incluso con atención médica de vanguardia. Esta situación se debe, en gran parte, al desconocimiento de los factores de riesgo por parte de la población y la subestimación de síntomas iniciales como cambios en el timbre normal de la voz, úlceras en la boca o sangrado.
“Aunque el CCyC se asocia con antecedentes de tabaquismo y consumo excesivo de alcohol, estos factores de riesgo han sido modificados y disminuidos por la población en general, sin embargo, actualmente son más frecuentes los asociados con el Virus del Papiloma Humano (VPH) con lesiones en la lengua” comenta Miguel Ángel Álvarez, médico oncólogo.
La lengua es uno de los órganos vulnerables al cáncer debido al contacto constante con irritantes como el tabaco, el alcohol, microlesiones y una higiene bucal deficiente. Un factor relevante en su relación con el VPH 16, que puede alojarse en la base de la lengua y la zona orofaríngea durante prácticas sexuales orales sin protección y de alto riesgo. En algunas personas, este virus permanece en el cuerpo sin causar molestias y con el tiempo puede desencadenar alteraciones que dan lugar al desarrollo de cáncer en esa zona.
Según la OPS, más del 80% de las personas sexualmente activas tendrán VPH en su vida. “Hoy sabemos que el VPH está detrás del 70% de los cánceres de orofaringe en jóvenes menores de 45 años. Es un fenómeno creciente que nos obliga a repensar el vínculo entre la sexualidad y la detección oportuna”, puntualizó Álvarez.
En el contexto del creciente número de casos de cáncer en la cavidad oral, especialmente entre personas jóvenes, es fundamental tomar medidas cotidianas que pueden marcar una gran diferencia. Es importante no subestimar cualquier alteración en la lengua y en la zona orofaríngea (segunda área con más lesiones cancerígenas), prestando especial atención a llagas que no cicatrizan, dolor al hablar o tragar, manchas blancas, rojas o mixtas en su superficie, sangrado sin motivo claro, sensación de entumecimiento, bultos palpables y mal aliento persistente.
Hoy también publicamos las siguientes notas y más...