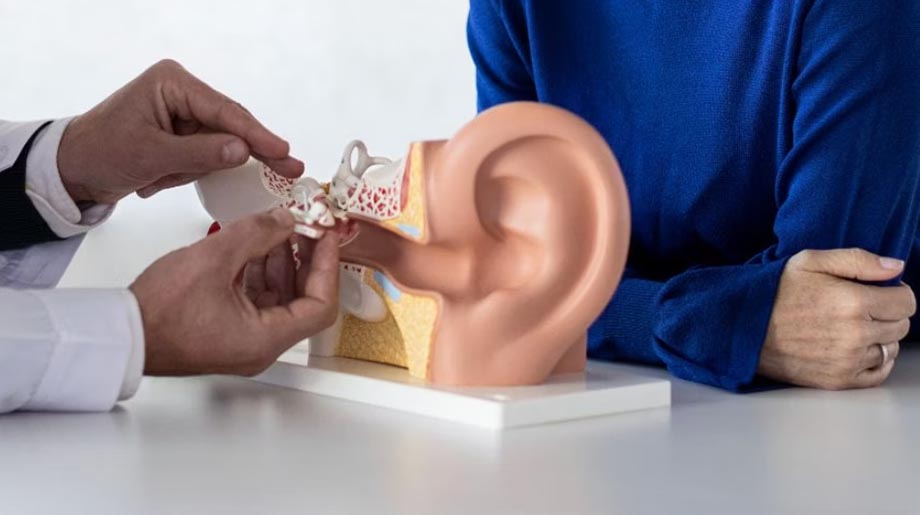
Comunicado. MED-EL, proveedor de soluciones médicas auditivas, señaló que el síndrome de Ménière es un trastorno del oído interno que provoca episodios de vértigo, zumbidos en el oído y pérdida auditiva temporal. También conocido como vértigo de Ménière, suele afectar a personas de entre 20 y 50 años, impactando en algunos casos la audición; sin embargo, con un diagnóstico oportuno y un tratamiento adecuado permiten lograr grandes avances, especialmente en casos de pérdida auditiva profunda, ya que existen soluciones avanzadas de origen austriaco capaces de ayudar a recuperar la audición.
Además de los síntomas mencionados, la enfermedad de Ménière también puede generar una sensación de presión en el oído y una pérdida auditiva que, en sus primeras etapas, suele ser temporal, pero con el tiempo puede volverse permanente. La enfermedad de Ménière generalmente afecta un solo oído, aunque en algunos casos logra comprometer ambos. Se cree que su origen está relacionado con un desequilibrio de líquidos en el laberinto del oído interno, una estructura clave para la audición y el equilibrio. El exceso de este líquido provoca episodios de vértigo y otros síntomas característicos.
“La enfermedad de Ménière no siempre causa pérdida auditiva, aunque es un síntoma frecuente que podría variar con el tiempo, mejorando o empeorando en diferentes momentos. Esta condición llega a ser altamente incapacitante, por lo que un diagnóstico temprano y un tratamiento adecuado son esenciales. En casos de hipoacusia, las soluciones van desde el uso de audífonos hasta alternativas más avanzadas, como los implantes cocleares de tecnología austriaca, que permiten recuperar la audición en los casos de sordera severa”, señaló Dulce María García Jacuinde, médico audióloga y de soporte clínico en MED-EL México.
Las causas exactas del síndrome de Ménière no están completamente claras. Algunos especialistas lo asocian con problemas en la circulación sanguínea del oído interno, infecciones virales, alergias o respuestas autoinmunes. También se han identificado posibles factores genéticos, dado que en algunos casos la enfermedad parece afectar a varios miembros de una misma familia.
La Secretaría de Salud indica que este trastorno puede ser difícil de diagnosticar, ya que en ocasiones suele confundirse con otras afecciones del oído. Por ello, se deben realizan diversas pruebas para obtener un diagnóstico preciso. Acudir a un especialista es fundamental, solo ellos pueden indicar el tratamiento adecuado para cada caso.
Hoy también publicamos las siguientes notas y más...
Pfizer venderá 662 millones de sus títulos en Haleon, fabricante de Sensodyne
Los mejores profesionales farmacéuticos de la región asistieron al FarmaForum El Salvador