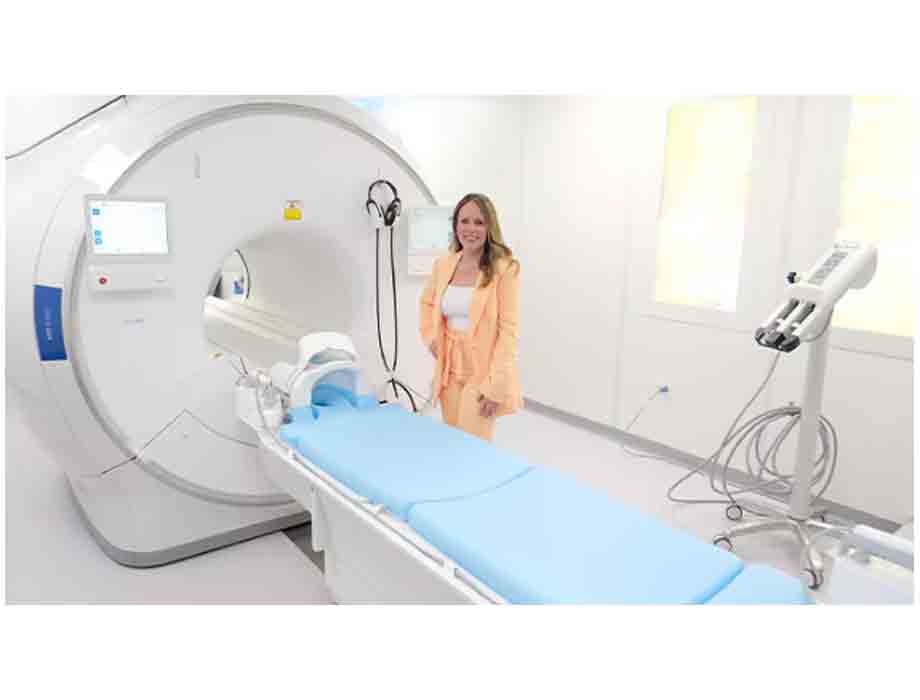
Comunicado. Royal Philips anunció la instalación número 1,111 de su revolucionario magneto BlueSeal 1.5T, que se llevó a cabo en Vida Imaging & Breast Center en Puerto Rico (Bayamón, Puerto Rico). Más allá de sus beneficios económicos y de sostenibilidad, las operaciones de resonancia magnética sin helio también aumentan la resiliencia frente a las tormentas tropicales que azotan a Puerto Rico cada año, brindando atención de calidad a pacientes que de otro modo no tendrían acceso a resonancias magnéticas avanzadas.
“La instalación de nuestro escáner Philips MR 5300, con un diámetro de 70 cm y equipado con el magneto BlueSeal número 1,111 en Vida Imaging & Breast Center en Puerto Rico, es un testimonio de la adopción global de nuestra tecnología innovadora. Desde 2018, Philips ha sido el primero en proporcionar operaciones de RM sin helio en todo el mundo, mejorando el acceso a una mejor atención para más pacientes, y continuaremos impulsando la innovación en este espacio", dijo Ruud Zwerink, Líder de Negocios de RM en Philips.
Y agregó: “La tecnología del magneto BlueSeal ha demostrado ser el sistema de elección para mejorar las capacidades de diagnóstico, al tiempo que proporciona una respuesta a las crecientes preocupaciones sobre las interrupciones de la cadena de suministro de helio, ahorrando aproximadamente 1.9 millones de litros de helio líquido hasta la fecha”.
La capacidad de un magneto BlueSeal para apagarse y volver a energizarse de forma controlada, sin la pérdida de su refrigerante de helio líquido, significa que puede estar en funcionamiento precisamente cuando se necesita para tratar a los pacientes. Vida Imaging & Breast Center, que ofrece una amplia gama de servicios de imágenes médicas, es un activo vital para la comunidad que ayuda a los pacientes de la remota isla de Puerto Rico a recibir atención médica de alta calidad.
“Puerto Rico tiene tormentas tropicales todos los años. La tecnología de magneto BlueSeal de Philips nos permite desenergizar nuestro sistema de RM para preparar al departamento de RM para esta situación y restaurar las operaciones rápidamente una vez que sea seguro, todo desde la consola de RM”, Mayra Maldonado, propietaria y directora ejecutiva de Vida Imaging & Breast Center.
Hoy también publicamos las siguientes notas y más...
FDA prueba la extensión de tratamiento de Almirall para queratosis actínica