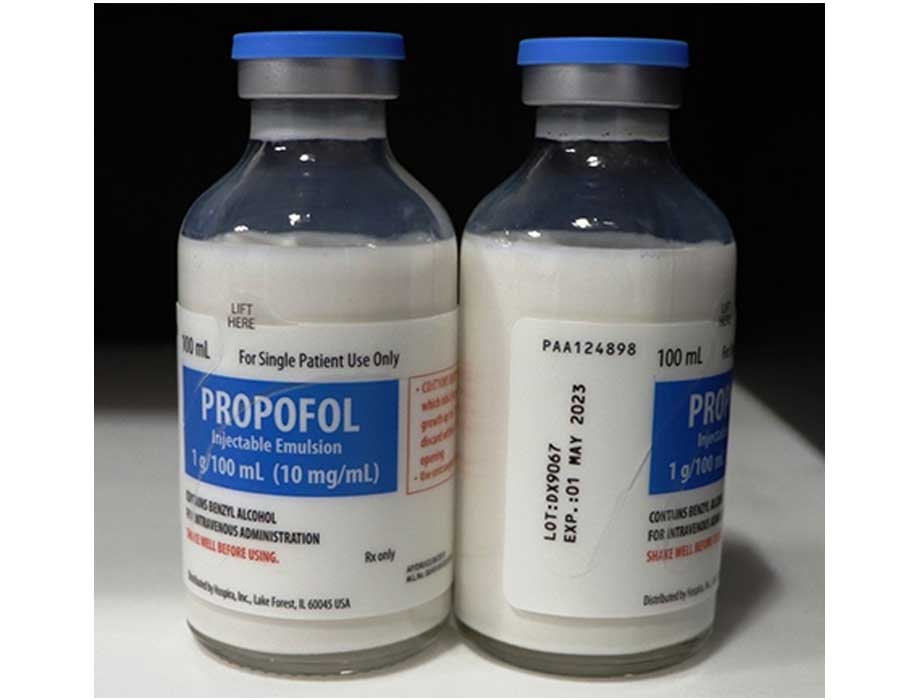
Comunicado. Hospira, empresa de Pfizer, anunció que está retirando voluntariamente del mercado estadounidense un lote de emulsión inyectable de propofol, USP (que contiene alcohol bencílico), vial de vidrio con tapa abatible de 100 ml para uso en un solo paciente; lote DX9067, al nivel del usuario debido a una partícula visible observada en un solo vial durante el examen anual de muestras retenidas.
La compañía indicó, en la declaración de riesgo, que los pacientes que reciben el producto afectado corren el riesgo de experimentar efectos clínicos adversos potencialmente mortales que incluyen, entre otros: bloqueo de los vasos sanguíneos, incluida la disminución del flujo sanguíneo al cerebro, ataque cardiaco, embolia pulmonar y necrosis tisular. También pueden ocurrir reacciones de hipersensibilidad y transmisión de enfermedades infecciosas.
Hasta la fecha, Hospira no ha recibido informes de eventos adversos asociados con este problema para este lote.
El propofol es un anestésico general intravenoso y un fármaco sedante para su uso en la inducción y el mantenimiento de la anestesia o la sedación. La emulsión inyectable de propofol, USP es un producto esterilizado terminalmente (TS). Es una emulsión estéril, no pirogénica que contiene 10 mg/ml de propofol adecuada para la administración intravenosa suministrada en un vial con tapa abatible para uso en un solo paciente.
El NDC (vial 0409-4699-54, caja: 0409-4699-24), el número de lote (DX9067), la fecha de caducidad (01 MAYO 2023) y los detalles de configuración de la emulsión inyectable de propofol, USP, fueron señalados por la compañía. El lote del producto se distribuyó en todo el país a mayoristas/hospitales/Departamento de Defensa de Estados Unidos desde el 10 de junio de 2020 hasta el 26 de junio de 2020.
Hospira ha notificado a los destinatarios directos por carta para organizar la devolución de cualquier producto retirado. Los mayoristas u hospitales con un inventario existente del lote que se está retirando del mercado deben suspender el uso y la distribución y ponerse en cuarentena de inmediato. Si ha distribuido más el producto retirado, al mayorista o al nivel/institución hospitalaria, notifique cualquier cuenta o ubicación adicional que pueda haber recibido el producto retirado de usted. Los hospitales/instituciones deben informar a los profesionales sanitarios de su organización sobre este retiro.
Hoy también publicamos las siguientes notas y más...
Medicamentos en Perú son 66% más económicos que en el promedio de países de la región: estudio
Conacyt y el INSP firman convenio para fortalecer formación e investigación en salud pública