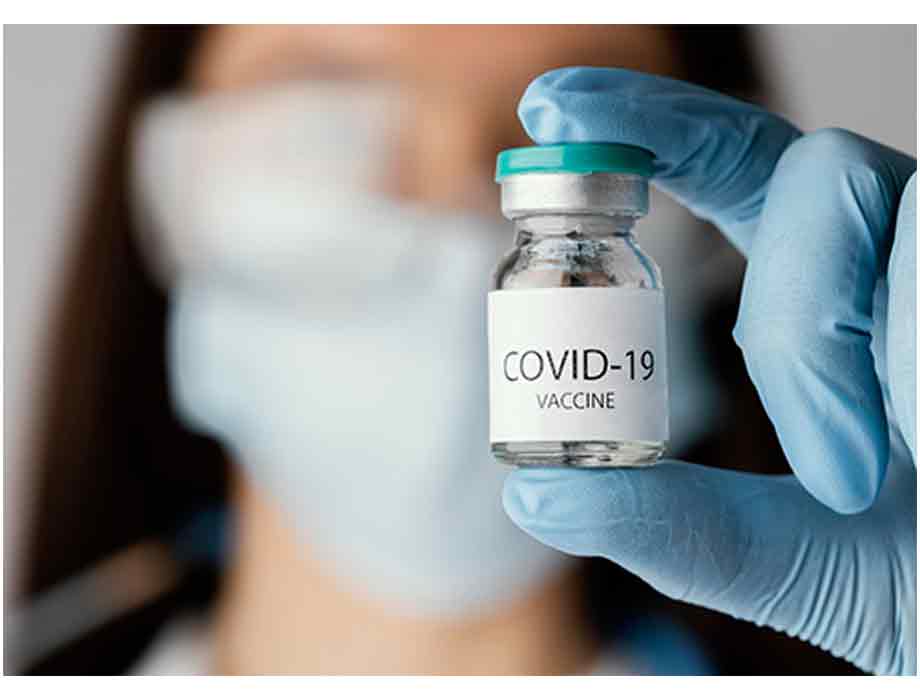
Comunicado. CorDx, empresa especializada en el desarrollo, fabricación y distribución de diagnósticos y otros dispositivos médicos, anunció que recibió recientemente una Autorización de uso de emergencia (EUA) de la FDA por su prueba Covid-19 Ag diseñada para uso doméstico sin receta y con un tiempo de resultado de 10 minutos.
La prueba CorDx Covid-19 Ag es un dispositivo de inmunoensayo de flujo lateral destinado a la detección cualitativa del antígeno de la proteína de la nucleocápside del virus SARS-CoV-2.
“Tomamos en serio cualquier amenaza a la salud pública. La principal misión de CorDx es desarrollar, fabricar y distribuir productos de diagnóstico confiables y asequibles que protejan la salud y salven vidas. Nos sentimos honrados de utilizar nuestra cadena de suministro integrada para proporcionar la prueba CorDx Covid-19 Ag a familias en Estados Unidos”, dijo Jeff Yufeng Li, fundador y director ejecutivo de CorDx.
Cabe indicar esta prueba está autorizada por la FDA bajo una EUA. Este producto ha sido autorizado únicamente para la detección de proteínas del SARS-CoV-2, no para ningún otro virus o patógeno. El uso de emergencia de este producto sólo está autorizado durante la declaración de que existen circunstancias que justifican la autorización del uso de emergencia de diagnósticos in vitro para la detección y/o diagnóstico de Covid-19.
Hoy también publicamos las siguientes notas y más...
Xeris Biopharma y Horizon Therapeutics trabajarán en tratamiento para enfermedad ocular tiroidea
Eurofarma ingresa al mercado norteamericano con la compra de Medimetriks Pharmaceuticals